Оксид фосфора фосфорная кислота соль. Оксиды фосфора и фосфорные кислоты
Элемент фосфор образует ряд оксидов, наиболее важными из них являются оксид фосфора (III) P2O3 и оксид фосфора (V) P2O5 .
Оксид фосфора (III), или фосфористый ангидрид (P2O3) получают при медленном окислении фосфора, сжигая его в недостатке кислорода. Представляет собой воскообразную кристаллическую белую массу с температурой плавления 22,5 °C. Ядовит.
Химические свойства:
1) вступает в реакцию с холодной водой, образуя при этом фосфористую кислоту H3PO3;
2) взаимодействуя с щелочами, образует соли – фосфиты;
3) является сильным восстановителем.
Взаимодействуя с кислородом, окисляется до оксида фосфора (V) P2O5.
Оксид фосфора (V), или фосфорный ангидрид (P2O5) получают при горении фосфора на воздухе или в кислороде. Представляет собой белый кристаллический порошок, с температурой плавления 36 °C.
Химические свойства:
1) взаимодействуя с водой, образует орто-фосфорную кислоту H3PO4;
2) имея свойства кислотного оксида, вступает в реакции с основными оксидами и гидроксидами;
3) способен к поглощению паров воды.
Конец работы -
Эта тема принадлежит разделу:
Шпаргалка по неорганической химии
Шпаргалка по неорганической химии... Ольга Владимировна Макарова...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Все темы данного раздела:
Материя и ее движение
Материя – это объективная реальность, обладающая свойством движения. Все существующее есть различные виды движущейся материи. Материя существует независимо от созна
Вещества и их изменение. Предмет неорганической химии
Вещества– виды материи, дискретные частицы которых имеют конечную массу покоя (сера, кислород, известь и т. д.). Из веществ состоят физические тела.
Каждое
Периодическая система элементов Д.И. Менделеева
Периодический закон был открыт в 1869 году Д.И. Менделеевым. Им же была создана классификация химических элементов, выраженная в форме периодической системы. До Ме
Значение периодической системы Менделеева.
Периодическая система элементов явилась первой естественной классификацией химических элементов, показавшей, что они взаимосвязаны друг с другом, а также послужила дальнейшим исследованиям.
Теория химического строения
Теорию химического строенияразработал А.М. Бутлеров.Она имеет следующие положения:
1) атомы в молекулах соединены друг с
Общая характеристика P-, S-, D-элементов
Элементы в периодической системе Менделеева делятся на s-, p-, d-элементы. Это подразделение осуществляется на основе того, сколько уровней имеет электронная оболочка атома элемента
Ковалентная связь. Метод валентных связей
Химическая связь, осуществляемая общими электронными парами, возникающих в оболочках связываемых атомов, имеющих антипараллельные спины, называется атомной, или ковалентной
Неполярная и полярная ковалентные связи
При помощи химической связи атомы элементов в составе веществ удерживаются друг возле друга. Тип химической связи зависит от распределения в молекуле электронной плотности.
Многоцентровые связи
В процессе развития метода валентных связей выяснилось, что настоящие свойства молекулы оказываются промежуточными между теми, которые описывает соответствующая формула. Такие молек
Ионная связь
Связь, возникшая между атомами с резко выраженными противоположными свойствами (типичным металлом и типичным неметаллом), между которыми возникают силы электростатического притяжени
Водородная связь
В 80-х годах XIX в. М.А. Ильинскийи Н.Н. Бекетовустановили, что атом водорода, соединенный с атомом фтора, кислорода или азота, способен образовыва
Превращение энергии при химических реакциях
Химическая реакция– превращение одного или нескольких исходных веществ в другие по химическому составу или строению вещества.
По сравнению с ядерными реакц
Цепные реакции
Существуют химические реакции, в которых взаимодействие между компонентами происходит довольно просто. Существует весьма обширная группа реакций, протекающих сложно. В этих реакциях
Общие свойства неметаллов
Исходя из положения неметаллов в периодической системе Менделеева, можно выявить свойства для них характерные. Можно определить количество электронов на внешнем эн
Водород
Водород (Н)– 1-й элемент периодической системы Менделеева – I и VII группа, главная подгруппа, 1 период. На внешнем s1-подуровне имеется 1 валентный электрон и 1 s2
Перекись водорода
Пероксид, или перекись водорода– кислородное соединение водорода (перекись). Формула: Н2О2 Физические свойства:перекись водорода – бесцветная сироп
Общая характеристика подгруппы галогенов
Галогены– элементы VII группы – фтор, хлор, бром, йод, астат (астат мало изучен в связи с его радиоактивностью). Галогены – ярко выраженные неметаллы. Лишь йод в ре
Хлор. Хлороводород и соляная кислота
Хлор (Cl) –стоит в 3-м периоде, в VII группе главной подгруппы периодической системы, порядковый номер 17, атомная масса 35,453; относится к галогенам.
Краткие сведения о фторе, броме и йоде
Фтор (F); бром (Br); йод (I)относятся к группе галогенов. Стоят в 7-й группе главной подгруппы периодической системы. Общая электронная формула: ns2np6.
Общая характеристика подгруппы кислорода
Подгруппа кислорода, или халькогенов – 6-я группа периодической системы Д.И. Менделле-ва, включающая следующие элементы:
1) кислород – О;
2) сера
Кислород и его свойства
Кислород (О)стоит в 1 периоде, VI группе, в главной подгруппе. р-элемент. Электронная конфигурация 1s22s22p4. Число электронов на внешнем ур
Озон и его свойства
В твердом состоянии у кислорода зафиксировано три модификации: ?-, ?– и?– модификации. Озон (О3) –одна из аллотропных модификаций кислорода
Сера и ее свойства
Сера (S)в природе встречается в соединениях и свободном виде. Распространены и соединения серы, такие как свинцовый блеск PbS, цинковая обманка ZnS, медный блеск Cu
Сероводород и сульфиды
Сероводород (H2S) –бесцветный газ с резким запахом гниющего белка. В природе встречается вводах минеральных ключей вулканических газах, гниении отбросов, а также пр
Свойства серной кислоты и ее практическое значение
Структура формулы серной кислоты:
Получение:основным методом производства серной кислоты из SO3 является контактный метод.
Химические свойства.
1. Концентрированная серная кислота является сильным окислителем. Окислительно-восстановительные реакции требуют нагревания, а продуктом реакции в основном является SO2 .
Получение.
1. В промышленности азот получают путем сжижения воздуха с последующим испарением и отделением азота от других газовых фракций воздуха. Полученный азот содержит примеси благородных газов (аргона).
Общая характеристика подгруппы азота
Подгруппа азота – пятая группа, главная подгруппа периодической системы Д.И. Менделеева. В нее входят элементы: азот (N) ; фосфор (P) ; мышьяк (
Нашатырь (хлорид азота).
Получение: впромышленности до концаХ1Х векааммиак получали как побочный продукт при коксовании каменного угля, который содержит до 1–2 % азота.
В начале
Соли аммония
Соли аммония– сложные вещества, включающие катионы аммония NH4+ и кислотные остатки.
Физические свойства:соли аммония – т
Оксиды азота
С кислородом Nобразует оксиды: N2O, NO, N2O3 NO2, N2O5 и NO3. Оксид азота I – N2O –закись азота, «веселящий газ». Физические свойства:
Азотная кислота
Азотная кислота– бесцветная, «дымящаяся» на воздухе жидкость с едким запахом. Химическая формула HNO3.
Физические свойства.При температуре
Аллотропные модификации фосфора
Фосфор образует несколько аллотропных видоизменений – модификаций. Явление аллотропных модификаций у фосфора вызвано образованием различных кристаллических форм. Белый фосфо
Фосфорные кислоты.
Фосфорному ангидриду соответствует несколько кислот. Главная из них – ортофосфорная кислота H3PO4 . Фосфорная кислота обезвоженная представлена в виде бесцветных прозрачных кристал
Минеральные удобрения
Минеральные удобрения– неорганические вещества, в основном соли, включающие в себя необходимые для растений элементы питания и используемые для повышения плодородия
Углерод и его свойства
Углерод (С)– типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6.
Аллотропные модификации углерода
Углерод образует 5 аллотропных модификаций: кубический алмаз, гексагональный алмаз, графит и две формы карбина. Гексагональный алмаз найден в метеоритах (минерал
Оксиды углерода. угольная кислота
Углерод с кислородом образует оксиды: СО, СО2, С3О2, С5О2, С6О9 и др. Оксид углерода(II) – СО. Физические свойства:угарный газ, б
Кремний и его свойства
Кремний (Si) –стоит в 3 периоде, IV группе главной подгруппы периодической системы. Физические свойства:кремний существует в двух модификациях: амо
Существуют три типа внутренней структуры первичных частиц.
1. Суспензоиды (или необратимые коллоиды)– гетерогенные системы, свойства которых можно определить развитой межфазовой поверхностью. По сравнению с суспензиями более высокодисперсн
Соли кремниевой кислоты
Общая формула кремниевых кислот – n SiO2?m H2O.В природе находятся в основном в виде солей, в свободной форме выделены немногие, например, HSiO (орток
Получение цемента и керамики
Цементявляется важнейшим материалом в строительстве. Цемент получают обжигом смеси глины с известняком. При обжиге смеси CaCO3 (кальцированная сода)
Физические свойства металлов
Все металлы имеют ряд общих, характерных для них свойств. Общими свойствами считаются: высокая электропроводность и теплопроводность, пластичность.
Разброс параметров у мет
Химические свойства металлов
Металлыобладают низким потенциалом ионизации и сродством к электрону, поэтому в химических реакциях выступают в качестве восстановителей, в растворах образуют
Металлы и сплавы в технике
В периодической системе из 110 известных элементов 88 – металлы. В XX векепри помощи ядерных реакций были получены радиоактивные металлы, которых не существ
Основные способы получения металлов
Большое количество металлов находится в природе в виде соединений. Самородными металламиназываются те, которые встречаются в свободном состоянии (золото, платина, р
Коррозия металлов
Коррозия металлов(corrosio – разъедание) – физико-химическая реакция металлов и сплавов с окружающей средой, в результате чего они теряют свои свойства. В основе ко
Защита металлов от коррозии
Защита металлов и сплавов от коррозии в агрессивных средах основывается на:
1) повышении коррозионной стойкости самого материала; 2) снижении агрессивности
Общая характеристика подгруппы лития
Подгруппа лития– 1 группа, главная подгруппа – включает щелочные металлы: Li – литий, Na – натрий, K – калий, Cs – цезий, Rb – рубидий, Fr – франций. Общая электрон
Натрий и калий
Натрий и калий –щелочные металлы, стоят в 1 группе главной подгруппы.
Физические свойства: схожи по физическим свойствам: легкие серебрис
Едкие щелочи
Щелочи образуют гидроксиды щелочных металлов 1 группы главной подгруппы при растворении их в воде.
Физические свойства:растворы щелочей в воде мылкие на ощ
Соли натрия и калия
Натрий и калий образуют соли со всеми кислотами. Соли натрия и калия очень похожи по химическим свойствам. Характерная особенность этих солей – хорошая растворимость в воде, поэтому
Общая характеристика подгруппы бериллия
К подгруппе бериллия относятся: бериллий и щелочноземельные металлы: магний, стронций, барий, кальций и радий. Наиболее распространены в природе в виде соединений,
Кальций
Кальций (Са) –химический элемент 2-й группы периодической системы, является щелочноземельным элементом. Природный кальций состоит из шести стабильных изотопов. Конф
Оксид и гидроксид кальция
Оксид кальция (СаO) – негашеная или жженая известь– белое огнестойкое вещество, образованное кристаллами. Кристаллизуется в кубической гранецентрированной кристалли
Жесткость воды и способы ее устранения
Так как кальций широко распространен в природе, его соли в большом количестве содержатся в природных водах. Вода, имеющая в своем составе соли магния и кальция, называется ж
Общая характеристика подгруппы бора
Внешняя электронная конфигурация у всех элементов подгруппы – s2p1. Характерным свойством подгруппы IIIAявляется полное отсутствие металлических свойств у бора и ти
Алюминий. Применение алюминия и его сплавов
Алюминий расположен в 3-й группе главной подгруппы, в 3 периоде. Порядковый номер 13. Атомная масса ~27. Р-элемент. Электронная конфигурация: 1s22s22p63s23p1.На вне
Оксид и гидроксид алюминия
Оксид алюминия – Al2O3. Физические свойства:оксид алюминия – белый аморфный порошок или очень твердые белые кристаллы. Молекулярная масса = 101,96, плотность – 3,97
Общая характеристика подгруппы хрома
Элементы подгруппы хромазанимают промежуточное положение в ряду переходных металлов. Имеют высокие температуры плавления и кипения, свободные места на электронных о
Оксиды и гидроксиды хрома
Хром образует три оксида: CrО, Cr2О3 и CrО3. Оксид хрома II (CrО)– основный оксид – черный порошок. Сильный восстановитель. CrО растворяется в разбавленной соляной
Хроматы и дихроматы
Хроматы– соли хромовой кислоты Н2Сг04,существующей лишь водных растворах с концентрацией не выше 75 %. Валентность хрома в хроматах – 6. Хроматы ще
Общая характеристика семейства железа
Семейство железавходит в состав побочной подгруппы восьмой группы и является в ней первой триадой, включающей в себя железо, кобальти никел
Соединения железа
Оксид железа (II) FeO– черное кристаллическое вещество, нерастворимое в воде и щелочах. FeOсоответствует основание Fe(OH)2 .
Доменный процесс
Доменный процесс –выплавка чугуна в доменной печи. Доменная печь выкладывается огнеупорными кирпичами высотой 30 м и внутренним диаметром 12 м. Верхняя половина – ш
Чугун и стали
Сплавы железа – металлические системы, основным компонентом которых является железо.
Классификация сплавов железа:
1) сплавы железа с углеродом (н
Тяжелая вода
Тяжелая вода– оксид дейтерия D2O с кислородом природного изотопного состава, бесцветная жидкость без запаха и вкуса.
Тяжелая водабыла откр
Химические и физические свойства.
У тяжелой воды температура кипения – 101,44 °C, температура плавления – 3,823 °C.
Кристаллы D2Oимеют такую же структуру, как и кристаллы обычного льда, различие в размерах
Соли соляной кислоты
Соли соляной кислоты или хлориды– соединения хлора со всеми элементами, имеющими меньшее значение электроотрицательности.
Хлориды металлов
Оксиды и кислоты фосфора.
Химия Бора.
Электронная конфигурация:
Бор сравнительно мало распространен в природе. К главным природным соединениям
бора относятся борная кислота и соли борных кислот (наиб. известна бура ![]() ).
).
Бор расположен в третьей группе периодической системы, но по своим свойствам наиболее сходен не с другими элементами этой группы, а с элементом четвертой группы - кремнием (проявление «диагонального сходства»).
Как и кремний, бор образует соединения с металлами, многие из которых отличаются большой твердостью и высокими температурами плавления.
Свободный бор получают восстановлением борного ангидрида магнием (бор выделяется в виде аморфного порошка, загрязненного примесями).
Чистый кристаллический бор получают термическим разложением или восстановлением его галогенидов, а также разложением водородных соединений бора. Он имеет черный цвет и среди простых веществ по твердости уступает только алмазу.
Вода не действует на бор; концентрированные же серная и азотная кислоты окисляют его в борную кислоту . Например:
В + 3HN = + 3N
При комнатной температуре бор соединяется только с фтором, на воздухе он не окисляется.
Если нагреть аморфный бор до 700 °С, то он загорается и горит красноватым пламенем, превращаясь в оксид; при этом выделяется большое количество теплоты:
4В(К) + 30 2(г) = 2В 2 0 3 (к), ∆Н = -2508 кДж.
При высокой температуре бор соединяется со многими металлами, образуя бориды, например, борид магния Mg 3 B 2 .
Многие бориды очень тверды и химически устойчивы, причем сохраняют эти свойства при высоких температурах. Для них характерна также тугоплавкость.
С галогенами бор также реагирует при нагревании и образует вещества общей формулы ВГ 3 . В этих соединениях бор образует с галогенами плоские молекулы с углами между связями Г-В-Г, равными 120°. Такая геометрия молекул ожидается при рассмотрении отталкивания электронных пар валентной оболочки и на основании вр2-гибридизации орбиталей бора.
Галогениды бора, как и другие соединения бора неполимерного строения, являются электронодефицитными. Так, в молекуле трифторида бора при линейной комбинации 2s, 2рх, 2ру, 2рг АО бора и по одной валентной p-АО (с неспаренным электроном) каждого атома фтора образуется 4 + 3 = 7 молекулярных орбиталей. На этих МО попарно располагаются 3 + 3 = 6 электронов. Таким образом, в молекуле трифторида бора незанятыми остаются 7 - 6/2 = 4 МО. Одна из МО, перпендикулярная плоскости молекулы, не участвует в связывании с атомами фтора. Но она обладает достаточно низкой энергией за счет релаксации (сжатия в данном случае, см. рис. 4.35 и 4.36) р-орбитали бора под действием сильно электроотрицательного фтора. Поэтому размещение на данной МО электронной пары другого атома или иона становится энергетически выгодным, а молекула BF3 может, следовательно, быть акцептором электронной пары. Действительно, BF3 соединяется по донорно-акцепторному способу с водой, аммиаком и другими веществами; известен также комплексный анион BF4 Формально данный процесс можно изобразить схемой:

Во всех подобных соединениях ковалентность и координационное число бора равны четырем, а атом бора образует тетраэдрические структуры, определяемые минимумом энергии. Это объясняется отталкиванием 4-х электронных пар валентной оболочки или sp3-гибридизацией атома бора.
Бороводороды (бораны). При действии соляной кислоты на борид магния Mg3B2 получается сложная смесь различных бороводородов. Из этой смеси выделены в чистом виде следующие бороводороды:
Главным продуктом взаимодействия борида магния с соляной кислотой является тетраборан В 4 Н 10 - летучая жидкость (темп. кип. 18 °С), пары которой воспламеняются на воздухе. При хранении тетрабо- ран постепенно разлагается с образованием простейшего из полученных бороводородов - диборана В>Н6. Последний представляет собой газ, конденсирующийся в жидкость при -92,5 °С. На воздухе он не загорается, но водой, как и другие бороводороды, тотчас же разлагается с отщеплением водорода и образованием борной кислоты Н 3 ВО 3:
В 2 Н 6 + 6Н 2 0 - 2Н 3 ВО 3 + 6Н 2 .
Атомы бора в молекулах бороводородов связаны друг с другом водородными «мостиками», например:
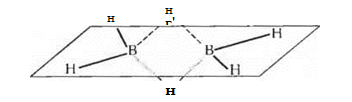
Штриховой линией и пунктиром на этой схеме показаны трехцентровые связи: здесь общая пара электронов занимает молекулярную орбиталь, охватывающую три атома - «мостиковый» атом водорода и оба атома бора. Такая орбиталь образуется вследствие перекрывания ls-орбитали атома водорода с sp 3 -гибридными орбиталями двух атомов бора. Четыре «концевых» атома водорода связаны с атомами бора обычными двухцентровыми двухэлектронными связями. Таким образом, из двенадцати валентных электронов имеющихся в атомах, составляющих молекулу диборана, восемь участвуют в образовании двухцентровых связей В -Н, а четыре образуют две трехцентровые связи В-Н-В.
Оксид бора, или борный ангидрид, В 2 0 3 может быть получен или путем непосредственного соединения бора с кислородом или прокаливанием борной кислоты. Борный ангидрид очень огнестоек и не восстанавливается углем даже при белом калении. В воде он растворяется с образованием в конечном итоге ортоборной кислоты и выделением теплоты:
Вг0 3 (к) + ЗН 2 0 (ж) =2НзВ0 3(р),
ДН = -76,5 кДж.
Ортоборная кислота Н 3 ВО 3 представляет собой белые кристаллы, блестящие чешуйки которых растворяются в горячей воде. В водном растворе ортоборная кислота находится в равновесии с другими кислотами бора:
Как правило, из различных кислот одного и того же элемента, отличающихся друг от друга степенью гидратации (т. е количеством связанных молекул воды), наиболее гидратированная форма является наиболее устойчивой в водных растворах. Из приведенных кислот бора наиболее устойчивой в водных растворах является ортоборная кислота. Поэтому в тех случаях, когда в ходе реакции должна получиться какая-либо борная кислота, в водных растворах всегда выделяется ее наиболее устойчивая форма - ортоборная кислота. При охлаждении раствора борная кислота выкристаллизовывается, так как в холодной воде она малорастворима.
Ортоборная кислота принадлежит к числу очень слабых кислот. Менее гидратированные ее формы (НВО 2 , Н 2 В 4 О 7) являются также слабыми кислотами, но несколько более сильными, чем ортоборная кислота. Такое правило о большей силе менее гидратированных форм одной и той же кислоты имеет место и в других случаях. Поэтому из слабых кислот бора несколько более сильной является тетраборная кислота.
В результате при попытке нейтрализации водного раствора ортоборной кислоты щелочью получается не ортоборат, а тетраборат щелочного элемента:
4Н 3 В0 3 + 2NaOH = Na 2 B 4 0 7 + 7H z O.
Соли борных кислот бораты большей частью являются производными не ортоборной кислоты Н3ВО3, а тетраборной и других более бедных водой борных кислот.
Соединения бора с азотом имеют две полиморфные модификации: алмазо- и графитоподобную. Графитоподобная модификация нитрида бора имеет структуру графита, в которой атомы бора чередуются с атомами азота, как в плоскостях, образуемых шестичленными кольцами, так и в перпендикулярных слоям плоскостях.
Билет 2.
2. Оксиды и их гидратные формы элементов V группы.
К главной подгруппе V группы периодической системы принадлежат азот, фосфор, мышьяк, сурьма и висмут.
Эти элементы, имея пять электронов на внешней электронной оболочке атома, характеризуются в целом как неметаллы. Благодаря наличию пяти наружных электронов, высшая положительная степень окисления элементов этой подгруппы равна -1-5, а отрицательная -3.
Оксиды азота.
Азот образует с кислородом ряд оксидов; все они могут быть получены из азотной кислоты или ее солей.
Оксид азота (I), или закись азота, N 2 О получается при нагревании нитрата аммония:
NH 4 NO 3 =N 2 0 + 2 H 2 0.
Оксид азота (I) представляет собою бесцветный газ, который используют в качестве наркоза.
Оксид азота (I) - термодинамически неустойчивое соединение. Стандартная энергия Гиббса его образования положительна. Однако вследствие большой прочности связей в молекуле N 2 0 энергии активации реакций, протекающих с участием этого вещества, высоки. В частности, высока энергия активации распада N 2 0. Поэтому при комнатной температуре оксид азота (I) устойчив. Однако при повышенных температурах он разлагается на азот и кислород; разложение идет тем быстрее, чем выше температура.
Ни с водой, ни с кислотами, ни с щелочью оксид азота (I) не реагирует.
Оксид азота(II ), или окись азота, N0 представляет собой бесцветный трудно сжижаемый газ.
По химическим свойствам оксид азота (II) относится к числу безразличных оксидов, так как не образует никакой кислоты.
Подобно N20 ОКСИД азота (II) термодинамически неустойчив. При комнатной температуре NO не разлагается, потому что его молекулы достаточно прочны. Лишь при температурах выше 1000 °С его распад на азот и кислород начинает протекать с заметной скоростью.
В лаборатории оксид азота (II) обычно получают взаимодействием 30- 35%-ной азотной кислоты с медью:
3Cu + 8HNO 3 = 3Cu(N0 3) 2 + 2NOt + 4Н 2 0.
В промышленности он является промежуточным продуктом при производстве азотной кислоты.
Для оксида азота (II) характерна окислительно-восстановительная двойственность. Под действием сильных окислителей он окисляется, а в присутствии сильных восстановителей - восстанавливается. Например, он легко окисляется кислородом воздуха до диоксида азота:
2NO + 0 2 = 2N0 2 .
В то же время смесь равных объемов N0 и Н 2 при нагревании взрывается: 2NO(r) + 2Н 2 (Г) = N 2 (r) 4- 2Н 2 0(Г), АН = -655 кДж.
Диоксид (или двуокись) азота N0 2 - бурый ядовитый газ. Изменение окраски диоксида азота при повышении температуры сопровождается и изменением его молекулярной массы.
Диоксид азота - очень энергичный окислитель. Многие вещества могут гореть в атмосфере NO 2 , отнимая от него кислород.
При растворении в воде NO 2 вступает в реакцию с водой, образуя азотную и азотистую кислоты: 2N0 2 + Н 2 0 = HNO 3 + HNO 2
Поэтому практически взаимодействие диоксида азота с водой, особенно с горячей, идет согласно уравнению 6N0 2 + 2H 2 0 = 4HN0 3 + 2N0, которое можно получить сложением двух предыдущих уравнений, если предварительно первое из них умножить на три.
В присутствии воздуха образующийся оксид азота немедленно окисляется в диоксид азота, так что в этом случае NO 2 в конечном итоге полностью переходит в азотную кислоту:
4N0 2 + 0 2 + 2Н 2 0 = 4HN0 3
Если растворять диоксид азота в щелочах, то образуется смесь солей азотной и азотистой кислот, например: 2N0 2 + 2NaOH = NaN0 3 + NaN0 2 + H 2 0.
Оксид азота (III), или азотистый ангидрид, N 2 O 3 представляет собой темно-синюю жидкость, уже при низких температурах разлагающуюся на N0 и NO 2 . Смесь равных объемов N0 и NO 2 при охлаждении вновь образует N 2 O 3: NO + NO 2 <=* N 2 O 3
Оксиду азота (III) соответствует азотистая кислота HNO 2 .
Оксид азота (V), или азотный ангидрид, N 2 O 5 - белые кристаллы, уже при комнатной температуре постепенно разлагающиеся на NO 2 и О 2 - Он может быть получен действием фосфорного ангидрида на азотную кислоту: 2HNO 3 + P 2 O 5 - N 2 O 5 + 2HPO 3
Оксид азота (V) - очень сильный окислитель. В воде оксид азота (V) хорошо растворяется с образованием азотной кислоты.
 В твердом состоянии.
В твердом состоянии.
Кислоты:
Азотистая кислота.
При действии на раствор какого-нибудь нитрита разбавленной серной кисло-той получается свободная азотистая кислота:
2NaN0 2 + H 2 S0 4 = Na 2 S0 4 + 2HN0 2 .
Она принадлежит к числу слабых и известна только в сильно разбавленных водных растворах. При концентрировании раствора или при его нагревании азотистая кислота распадается:
2HN0 2 = N0 + N0 2 + Н 2 0.
HN0 2 проявляет окислительно-восстановительную двойственность. Под действием восстановителей она восстанавливается (обычно до N0), а в реакциях с окислителями - окисляется до HNO3. Примерами могут служить следующие реакции:
2HN0 2 + 2KI + H 2 S0 4 = 2N0 +I 2 + K 2 S0 4 + 2H 2 0:
5HN0 2 + 2KMn0 4 + 3H 2 S0 4 = 5HN0 3 + 2MnS0 4 + K 2 S0 4 + 3H 2 0.
Азотная кислота .
Читай билет № 4.
Оксиды и кислоты фосфора.
К важнейшим оксидам фосфора принадлежат Р 2 0з и Р 2 0 5 .
Оксид фосфора (III), или фосфористый ангидрид, Р 2 0з получается пре медленном окислении фосфора или когда фосфор сгорает при недостаточном доступе кислорода. Молекулярная масса его при низких температурах соответствует формуле Р 4 0 6. При действии холодной воды оксид фосфора (III) медленно взаимодействует с ней, образуя фосфористую кислоту Н 3 РО 3 . Как оксид фосфора (III), так и фосфористая кислота обладают сильно выраженными восстановительными свойствами.
Оксид фосфора (V) , или фосфорный ангидрид, Р 2 0 5 образуется при горении фосфора на воздухе или в кислороде в виде белой объемистой снегообразной массы.
Оксид фосфора (V) жадно соединяется с водой и потому применяется как очень сильное водоотнимающее средство. На воздухе оксид фосфора (V), притягивая влагу, быстро превращается в расплывающуюся массу метафосфорной кислоты.
Фосфорные кислоты.
Оксиду фосфора (V ) отвечает несколько кислот. Важнейшая из них - это ортофосфорная кислота НзР0 4 , называемая обычно просто фосфорной. Другие фосфорные кислоты представляют собою полимерные соединения. В анионе всех фосфорных кислот атом фосфора, находящийся в состоянии «sр 3 -гибридизации, окружен четырьмя атомами кислорода, расположенными в вершинах тетраэдра. Ортофосфорная кислота построена из изолированных тетраэдров, в других фосфорных кислотах тетраэдры РО 4 объединены через атомы кислорода в агрегаты, содержащие от двух до весьма большого числа - порядка 10 5 - атомов фосфора.
Ортофосфорная кислота не принадлежит к числу сильных кислот. Будучи трехосновной, она образует три ряда солей: средние и кислые с одним или с двумя атомами водорода в кислотном остатке. Средние соли фосфорной кислоты называют ортофосфатами или просто фосфатами, кислые - гидрофосфатами:
В лаборатории фосфорную кислоту можно получать окислением фосфора 30%-ной HNO 3 . Реакция протекает согласно уравнению:
ЗР + 5HN0 3 + 2Н 2 0 = ЗН 3 РО 4 + 5N0
В промышленности фосфорную кислоту получают двумя методами: экстракционным и термическим. В основе экстракционного метода лежит обработка природных фосфатов серной кислотой:
Са 3 (Р0 4) 2 + 3H 2 S0 4 = 3CaS0 4 + 2Н 3 Р0 4
Все другие фосфорные кислоты представляют собой продукты соединения тетраэдров Р04. В большинстве своем эти кислоты не выделены в свободном состоянии, а известны в виде смесей, в водных растворах или в виде солей.
Оксиды фосфора. Фосфорный ангидрид Р;05 («простейшая» формула) является наиболее стабильным оксидом фосфора при обычных условиях. Это - белое кристаллическое (или стекловидное) очень гигроскопическое вещество состава Р4О10. Каждый атом фосфора окружен четырьмя атомами кислорода: Р4О,0 активно взаимодействует с водой, а также отнимает ее от других соединений, образуя в зависимости от условий либо метафосфорную HPOj, либо ортофосфорную HjPO* либо пиро-фосфорную Н4Р2О7 кислоты [см. реакции (12.5)]. Именно поэтому РчО|0 широко используется как осушитель различных веществ от паров воды. Фосфористый ангидрид описывается простейшей формулой Р203 и истинной формулой Р4Об: Фосфор в Р4Об координационно ненасыщен и поэтому является неустойчивым. Диоксид фосфора (III) - белая воскообразная масса, образуемая при окислении фосфора в условиях недостатка кислорода [см. уравнение реакции (16.4)]. Взаимодействие Р«06 с водой приводит к образованию фосфористой кислоты Р406+6Н20=4Н3Р03 Газообразный НС1 разлагает Р4Об: Фосфорные кислоты - под этим названием объединяют кислоты, содержащие атомы фосфора в степени окисления +5. Из трех фосфорных кислот наибольшее практическое значение имеет ортофосфорная кислота HjP04 (часто ее называют просто фосфорной) - белое твердое вещество =44,4 °С), хорошо растворимое в воде. В водном растворе она диссоциирует ступенчато, образуя три вида анионов (дигидрофосфаты Н2Р04~, гидрофосфаты НР042 ~ и фосфаты Р043~) и находясь с ними в равновесии в соответствии с константами диссоциации: Очень наглядно это иллюстрирует диаграмма на рис. 16.2, показывающая долю каждой из частиц в зависимости от кислотности раствора (рН раствора). Например, доля самой кислоты a(H3P04), определяемая формулой превалирует, если. И наоборот, только при pH>p£s начинает превалировать доля фосфат-ионов Р043~\ Промежуточные ионы доминируют при значениях рН, которые находятся между рК2 и рКъ. Все дигидрофосфаты растворимы в воде. Из гидрофосфатов и фосфатов в воде растворимы только соли щелочных металлов и аммония (см. таблицу растворимости). Соли фосфорной кислоты - ценные минеральные удобрения. Наиболее распространенные среди них - суперфосфат, преципитат и фосфоритная мука. Простой суперфосфат - смесь диги-дрофосфата кальция Са (Н2Р04)2 и «балласта» CaS04. Его получают, обрабатывая фосфориты и апатиты серной кислотой. При обработке минеральных фосфатов фосфорной кислотой получа- Ряс. 16.2. Доля равновесных «гастяц в зависимости от рН раствора при многоступенчатой диссоциации Н3Р04 ют двойной суперфосфат Са(Н2Р04)2. При гашении фосфорной кислоты известью получают преципитат. Важное значение имеют сложные удобрения (т. е. содержащие одновременно азот и фосфор; или азот, фосфор и калий). Из них наиболее полезен аммофос - смесь NHJH2P04 и (NH^HPCV Так же как ортофосфорная кислота, пирофосфорная Н4Р2О7 (четырехосновная) - кислота средней силы. Соли этой кислоты - пирофосфаты - в водных растворах гидролизуются я да» ют слабощелочную среду. Пирофосфорную кислоту получают либо нагреванием 100%-ной ортофоофорной кислоты, либо добавляя в последнюю диоксид фосфора (V): В отличие от других фосфорных кислот метафосфорная НР03 - сильная кислота и, как следствие, ее соли - метафос-фаты - не гндролизуются водой. Именно метафосфорная кислота образуется при поглощении диоксидом фосфора (V) воды: «Отнимая» воду от 100%-нон HN03, диоксид фосфора (V) также образует метафосфорную кислоту: При кипячении раствора метафосфорной кислоты образуется ортофосфорная: Низшие фосфоркнслородные кислоты. Выше было показано, что при взаимодействии Р406 с водой образуется фосфористая кислота HjP03: Несмотря на то, что кислота содержит три атома водорода, - она двухосновная, так как третий атом водорода «не кислый», т. е. не диссоциирует в водных растворах и не замещается (см. структуру). Фосфористая кислота - кислота средней силы образует два ряда солей - фосфиты или гидрофосфиты. Известна также одноосновная фосфорноеа-тистая кислота Н3РО2 средней силы (I0~2)f соли - гипо-фосфиты.


