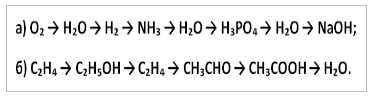
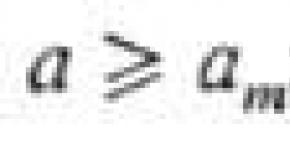Vee roll keemilistes protsessides. Ettekanne teemal „Vee roll keemilistes reaktsioonides
Kõrged harud ülestõusvad Mürgine merevesi
Ja upub, nagu mängides, Suured merelaevad
Ookeani suur laius Ja tiigi vaikne veealus, Vesipiiri kaskaad ja purskkaevupursk, Ja kõik see on lihtsalt vesi.
Pitsis nagu riietatud Puud, põõsad, juhtmed. Ja tundub muinasjutt, Ja sisuliselt - ainult vesi.
Kuidas talvel riided kohevaks Lumivalge emakeeled, Aga aeg tuleb, kõik sulab, ja seal on lihtne vesi.

Keemia õppetund klassis 11
« Vee roll keemilistes reaktsioonides »
Ettekanne on koostatud:
keemiaõpetaja
MBOUSOSH №1 S. Aleksandrov - Guy
Belova Svetlana Sergeevna

Vee roll keemilistes reaktsioonides
Elektrolüütide vesilahuste keskkond

Vesi dissotsieerub ioonideks: H 2 Oh ↔ H + + HE - ,
selle püsivus 25 ° C juures ° Koos võrdub
[ H + ] · [ OH - ]
[ H 2 Oh ]
Järelikult on see konstantsete väärtuste toode
K d ∙ = = const.
Ioonide saaduse arvväärtus
mida nimetatakse vee eraldamiseks vee KH2O ioonprodukt see on võrdne
KH2O = [ H + ]·[ OH - ] = CD ·[ H2O ] = 10 -14
= 1,8 · 10 -16
Et D =
 1 ∙ 10 –7 - happeline –7-leeliselises keskkonnas. "width =" 640 "
1 ∙ 10 –7 - happeline –7-leeliselises keskkonnas. "width =" 640 " Kui temperatuur on 15–25 ° C, siis ioon
veetööd K H 2 Oh = 10 –14 ,
seda võrdõiguslikkus ja vastab
neutraalses keskkonnas = = 1 ∙ 10 –7 ,
juures 1 ∙ 10 –7 - hapu,
juures –7 - leeliseline keskkond.
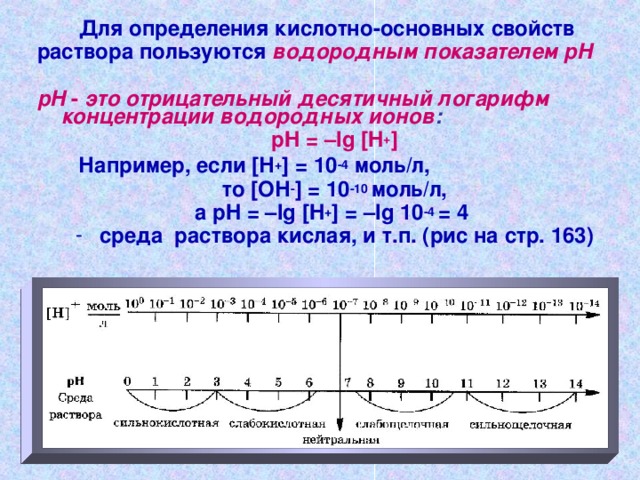
Happe-aluse omaduste määramiseks
mördi nautida pH
pH - see on vesiniku ioonide kontsentratsiooni negatiivne kümnendlogaritm :
pH = –lg
Näiteks, kui [ H + ] = 10 -4 mol / l,
seda [ OH - ] = 10 -10 mol / l,
a pH = –lg = –lg 10 -4 = 4
- kolmapäev happeline lahus jne. (Joonis lk 163)
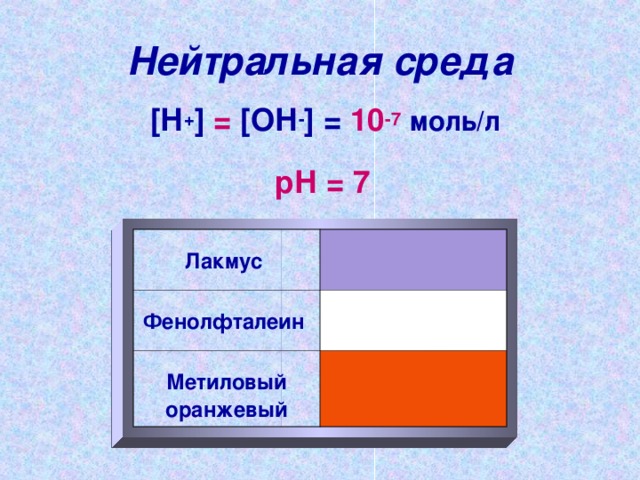
Neutraalne keskkond
[ H + ] = [ OH - ] = 10 -7 mol / l
pH = 7
Litmus
Fenoolftaleiin
Metüüloranž
 [OH -] 10 -7 mol / l pH 7 Litmuse fenoolftaleiin Metüüloranž "laius =" 640 "
[OH -] 10 -7 mol / l pH 7 Litmuse fenoolftaleiin Metüüloranž "laius =" 640 " Happeline keskkond
[ H + ] [ OH - ] 10 -7 mol / l
pH 7
Litmus
Fenoolftaleiin
Metüüloranž
 7 Litmuse fenoolftaleiinmetüüloranž "Laius =" 640 "
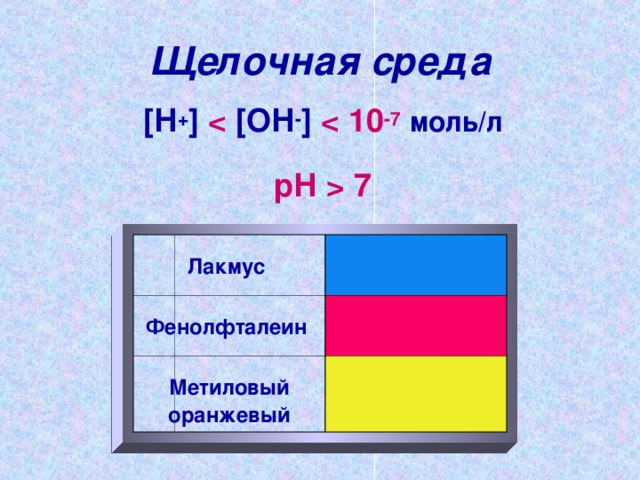
7 Litmuse fenoolftaleiinmetüüloranž "Laius =" 640 " Leeliseline keskkond
[ H + ] [ OH - ] 10 -7 mol / l
pH 7
Litmus
Fenoolftaleiin
Metüüloranž
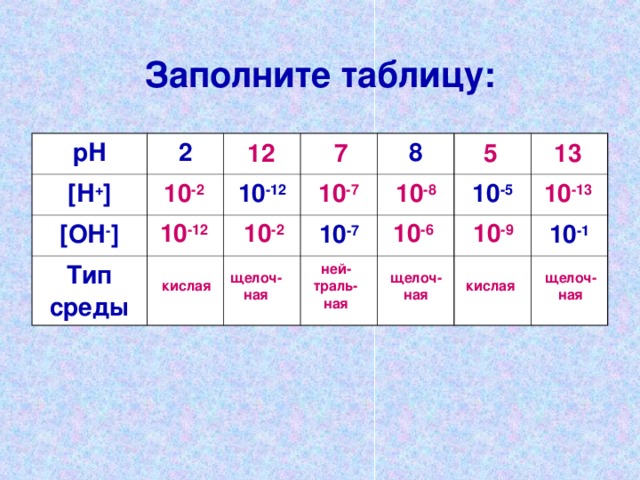
Täitke tabel:
[ H + ]
[ OH - ]
10 -12
Keskmine tüüp
10 -7
10 -5
10 -1
10 -13
10 -8
10 -7
10 -2
10 -2
10 -6
10 -9
10 -12
hapu
leeliseline
tema- traali
leeliseline
hapu
leeliseline

mõnede vedelike pH
Vesinikkloriidhape
tööstus -1.1
lahjendatud 0,0
Laetav
hape (väävelhape) 0,15
Maomahl 1.4
Sidrunimahl 2.1
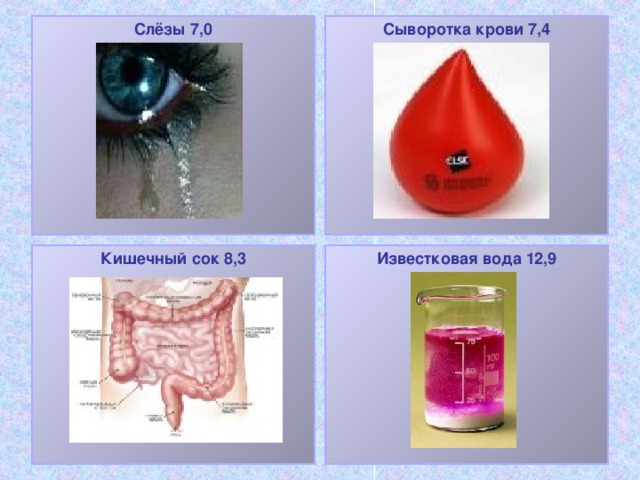
Pisarad 7.0
Vereseerum 7.4
Soole mahl 8.3
Lubjavesi 12.9
Grupitöö
- Analüütikud
- Teoreetikud

Määrake katseliselt ligikaudne pH väärtus ja vesinikuioonide kontsentratsioon järgmistes vedelikes:
Tomatimahl
Kohv
Pesupulbri lahus
WC-seebi lahus
Šampoonilahus

Kodutöö
1. Sõnumite ettevalmistamine:
- pH rolli kohta praktilises inimtegevuses, hüdrosfääri biokeemilistes protsessides;
- inimese keha füsioloogiliste vedelike (veri, sülg, uriin jne) pH väärtus
- Teade "Vere pH muutmine on ohtlik"
2. Probleemi lahendamine:
Määrake H ioonide sisaldus + pisaras
laps (0,03 ml, pH = 7,3).
Kujutiste ja slaididega esitluse vaatamiseks laadige see alla ja avage see oma arvutis PowerPointis.
Slaidide teksti sisu:
Noh, võta oma müts kiiresti välja! Ma olen ruumi isa tütar ja see on kõikjal ja valgus, - ma olen jää, ma higin, ma olen pilved, mul on külm, tee, puljong, udu, jõgi, ookean ja ookean. Ja ma külmutan. Vesi „Vee roll keemilistes reaktsioonides” 11. klassi esineja: SyktyvkaraYurina 1-nda gümnaasiumi 1. kvalifikatsioonikategooria õpetaja Alexandra Viktorovna Maa pind on 71% vett 1. Vee mitmekülgne roll H2O-ainete muundamisel reaktsioonikeskkonnaks Reaktsioonid jätkuvad lahustes Vees lahustuv Lahustuv (rohkem kui 1 g ainet lahustub 100 g vees) Leelishüdroksiidid Mina, peaaegu kõik nitraadid, kõik monosahhariidid, madalamad alkoholid Karboksüülhapped Vähesel määral lahustuv (100 g vett lahustub 0,01 kuni 1 g ainet) Ca (OH) 2, BaF2 ja AlF3, hõbe ja pliisulfaat, aniliin ja fenool Peaaegu lahustumatu (100 g vett lahustub vähem kui 0,01 g ainet) Peaaegu kõik fosfaadid ja karbonaadid; Kõik süsivesinikud; kõrgemad alkoholid Aldehüüdid Karboksüülhapped H2O reagendina. Vajalik reagent komplekssete biopolümeeride lagunemisreaktsioonides (hüdrolüüsi reaktsioonid). Biopolümeeride moodustumisel, polümerisatsioonil, eraldub H2O vesi dissotsiatsioonitegurina, veemolekulid on polaarsed, seega elektrolüüdid kergesti dissotsieeruvad vees H2O H2O katalüsaatorina * Kui sa lihtsalt segad neid, siis reaktsioon ei lähe - kui lisada tilk vett, hakkab reaktsioon kohe tilgutama. mine metsikult Alumiiniumi ja joodi kuivpulbrite koostoime. 2Al + 3J2 = 2AlJ3 + Q H2O ainete vedajana Kõik vedelad keskkonnad sisaldavad rohkem kui 90 - 98% vett, mis kannab organismi O2, toitained, hormoonid jne. Veri Annab CO2 ja lagunemisprodukte keha eemaldamise kohtadesse 2. Kristallivõre lahustumisprotsessid, lahustunud ainete difusioon, keemiline protsess - hüdratatsioon (lahustunud aine molekulide koostoime H2O-ga) a) hüdratsioonireaktsioon atsetüleen) CuSO4 + 5H2O = CuSO4 + 5H2O = CuSO4 * 5H2O sinised kristallid valge 3. Elektrolüütiline dissotsiatsioon Elektrolüüdid on ained, mis lagunevad lahuste ioonideks (dissotsieeruvad). Elektrolüütilise dissotsiatsiooni aste on lagunenud aine moolide arvu suhe. kohta ioonid kõigi soluudist elektrolüüdid tugev nõrk (dissotsiatsiooni määr kipuvad ühtsuse) (dissotsiatsiooni määr kipuvad null) Kõik leelise; Kõik soolad; Happed: HCI, HN03, H2SO4, HCI4, HBr, HJ, CF3COOH jne. Paljud anorgaanilised happed (H2S, H2CO3, HCN), peaaegu kõik orgaanilised happed. Happed Need on elektrolüütid, mis eralduvad vesiniku katioonidest ja happeliste jääkide anioonidest. Need on elektrolüütid, mis lahutavad vesiniku katioonidest ja happelistest jääkidest anioonid HCl = H + Cl HCOOH H + HCOO + - + - Alused Need on elektrolüütid, mis eralduvad metalli katioonidest (ammoonium või orgaaniline alus) ja hüdroksiid-anioonid KOH = K + OH CH3NH2 * H2O CH3NH2 + OH + - + - soolad Need on elektrolüüdid, mis eralduvad metalli katioonidest (ammoonium või orgaaniline alus) ja happe jäägi Al2 (SO4) 3 = 2Al + 3SO4 NH4NO3 = NH4 + anioonid. NO3 CH3COONa = Na + CH3COO 3+ 2- - + + - kodutöö 1. lk.17 - loe. Uuringu märkused märkmikus 2. Ioonivahetusreaktsioonid (kirjutage välja täielikud ja lühendatud ioonvõrrandid): A) K2S + 2HCl = B) K2S + NaNO3 = B) K2SO4 + Pb (NO3) 2 = 3. Taastab molekulaarsed võrrandid: A) Fe + 3OH = Fe (OH) 3B) 2H + S = H2SB) 3Ca + 2PO4 = Ca3 (PO4) 2 + 2- 3+ - Viited Keemia. 11. klass. Põhitase: uuringud. üldhariduse jaoks. institutsioonid / operatsioonisüsteem Gabrielyan. http://kozlenkoa.narod.ru/indexlessons.htmhttp://yandex.ru/images/searchhttp://forum.xumuk.ru/index.php?showtopic=97449
Lisatud failid
MBOU "Molodkovskaya SOSH"
Mglinski piirkond, Brjanski piirkond
Keemiaõpetaja: Shtyrkhunova Tatyana Aleksandrovna
Abstraktse keemia õppetund klassis 11 teemal "Vee roll keemilistes reaktsioonides".
Õppetundi eesmärk: süstematiseerida teadmised vee koostise, struktuuri, omaduste, looduses olemise, looduse probleemide kohta.
Õppetundi eesmärgid: 1. Kaaluda vee rolli erinevaid valdkondi keemilistes reaktsioonides.
2. Arendada loogilist mõtlemist, oskusi saada teavet erinevatest allikatest, arendada oskusi enesehinnangu ja enesehinnangu omandamiseks.
3. Harida veele suhtumist kui asendamatut ainet kõigi elusorganismide elus.
Õppetüüp: kombineeritud õppetund.
Kasutatud seadmed:arvuti, multimeedia projektor, kaardid, lahustuvustabel, mitmed aktiivsed metallid.
Kasutatud POR: arvuti esitlus.
Üliõpilaste keemilised teadmised, oskused ja oskused: õpilaste teadmiste süstematiseerimine vee iseloomu, füüsikaliste ja keemiliste omaduste, veekasutuse alade, õpilaste teadmiste kohta vee rollist, magevee keskkonnaprobleemidest.
Vormitud pädevused:
haridus- ja kognitiivne pädevus: oskuste arendamine, et võrrelda, analüüsida, tõestada, oskada lahendada järgmisi praktilisi ülesandeid: võimet hinnata keskkonnaseisundit, edendada oma ideid kohaliku maa veevarude kaitseks;informatiivne pädevus: võime analüüsida ja valida vajalikku teavet, võime valmistada ja sõnumeid teha, võime kasutada Internetti haridusteabe otsimiseks.
Õppetund.
1.Orizatsiooniaeg.
Kontrolli d.
Vastake rida küsimusi teemal: pöörduvad ja pöördumatud reaktsioonid, keemiline tasakaal.
2. Õpetaja sissejuhatav sõna.
Õpetaja Poisid, tänapäeva õppetundis tutvustame hämmastava ainega, selle füüsikaliste omaduste, anomaaliate, olemuse, väärtuse ja looduskaitsealadega. Kutsun teid üles tegema reisi imetlevate ümberkujunemiste maale ja hoidma oma õppetundi moto "Nägemise ja mõistmise rõõm on looduse suurim kingitus" (A. Einstein) Milline inimene selles riigis täna kokku saab?
Slaid 1. Lugesin värve vees.
Niisiis, millist ainet me klassis räägime?
Ma koostan õppetunni teema, tunnen õppetunni eesmärki.
"Vesi ... Sul ei ole maitset, värvi ega lõhna, sa ei suuda teid kirjeldada - sa naudid teadmata, mis sa oled.
Sa ei ole lihtsalt elu jaoks vajalikud, sa oled elu ise. Sa oled jumalus, sina oled täiuslikkusmaailma suurim rikkus "
Prantsuse kirjanik kirjutas selliseid sõnu vee kohta.Antoine de Saint-Exupery.
Ja meie õppetund on pühendatudkõige tuttavam ja samal ajal kõige salapäraneaine - vesi.
Kirjutame sülearvutitesse õppetundi teema: « Vee roll keemilistes reaktsioonides. "
Õpetaja sissejuhatavad märkused vee kohta:
Vesi on tuttav ja arusaamatu, hämmastav, paradoksaalne, salapärane, ettearvamatu. Ei ole mitmeid epiteete, mis võiksid seda ainulaadset ainet täielikult iseloomustada. See oli ja jääb muuseumiks, inspiratsiooniallikaks luuletajatele, kunstnikele, heliloojatele, teadlastele, kes paljude aastate jooksul lükkavad selle suure looduse loomingu saladused lahti ja ei ole enam üllatunud, mida nad õpivad.
Slaidide 2-6 tundmaõppimine.
Õpetaja Geograafiakursusest tead, et vesi on kõige levinum aine maailmas.
Sõnum 1. "Vesi maa peal"
Vesi on meie ümbritseva maailma kõige olulisem aine. Ta on nii tuttav kui ka võõras, tuntud ja salapärane ... Looduslik vesi! Vaadake taevast ja sa näed pilved või pilved, mis ulatuvad miili kaugusele. Kui lihtne need on! Aga ärge kujutage ette, et nad on kaalud. 1 km3 pilvede mass on umbes 2000 tonni ning Maa veeauru atmosfääris on umbes 12 300 km3 ja see on ka looduslik vesi. Igaüks teab praegustmaismaavood: ojad, ojad, jõed. Mõnikord levivad nad laialdaselt ja vabalt kogu tasandikust, moodustavad mõnikord jõulisi kärestikke, langevad vesiputouksista kümnete ja sadade meetri kõrguste kõrguste kohal, mis kannavad oma veed ookeanidesse ja meredesse. Ligikaudu 71% meie Maa pinnast on kaetud Maailma ookeaniga, mis moodustab umbes 97% kogu pinnaveest ja pool litosfäärist.
Nii palju või vähe vett Maal? Väga vähe! Maa kogumahust moodustab vesi umbes 2,5 miljardit km3.
Maa veekiht on 1,5 miljardit km3 ja ülejäänud maapõue sügavates kihtides. Enamik veest on soolane ja sobib eluks, värske, ainult umbes 5 miljonit km3. Igal aastal vajab inimene rohkem värsket ja puhast vett. Inimkond seisab silmitsi veereostuse kriisiga. Mõnes riigis on juba puhas puhas vesi ja nad on sunnitud seda välismaalt importima. Vesi peab olema kaitstud.
Õpetaja Bioloogiast saad teada, et vesi on lahutamatult seotud elu eluga Maa peal.
Kui palju vett inimkehas on?(65%- 75%)
Kas teadsite, et aju sisaldab80% vett.6 slaid
Teade 3. “Vesi elusorganismis”
Kõik elavad asjad meie planeedil 2/3 koosneb veest. Esiteks on mikroorganismid elusorganismi veesisalduse seisukohalt, teiseks on taimed, kolmandaks on loomad ja viimases kohas on inimene.
Bakterid on 81% vett, eosed on 50%, loomkuded on keskmiselt 70% ja lümfid 90%. Kõige veekindlam kude on silma klaaskeha, mis sisaldab kuni 99% niiskust.
Kehas olev vesi täidab mitmeid funktsioone: selles lahustunud ained reageerivad üksteisega, vesi aitab eemaldada metaboolseid jäätmeid, toimib temperatuuriregulaatorina, olles hea soojuse kandja ning määrdeaine.
Elusorganismides võib kudedes sünteesida vett. Näiteks, kaameli rasv, mis on kuplikas oksüdeerunud, võib anda kuni40 liitrit vett. Inimene, kes joob 2,5 liitrit vett päevas, peseb kõhtu iga päev 10 liitri vedelikuga ja aurustab 0,7 liitrit vett.
2 Veemolekuli struktuur jafüüsikalised omadused (7 slaidi ja 8).
(eesmine uuring)
Slaid 9. Leidke tekstis keemilised vead (me teostame tööd ees).
Õpetaja. Teie vastused on näidanud, et olete valmis edasiseks reisimiseks.
Jah, vee roll keemilistes reaktsioonides on mitmekülgne. Slaid 11.
12 slaidi.
Vesi on maailma parim lahusti, see lahustab palju tahkeid, vedelaid ja gaasilisi aineid. Merede ja ookeanide vesi sisaldab peaaegu kõiki perioodilise süsteemi elemente, miljardeid tonne metallimaare. Seepärast nimetatakse ookeani vett "vedelaks maagiks", naatriumi, kloori, kulda, uraani ja sellest saadakse erinevaid sooli.See vee omadus on looduse jaoks esmatähtis, peaaegu kõik keemilised muundumised Maa peal, sealhulgas elusorganismides, esinevad vees, selle juuresolekul või osalusel.
Molekulide kõrge polaarsuse tõttu on vesi võimeline lahustama palju aineid ioonsete ja kovalentsete polaarsete sidemetega.
Vee osas jagunevad ained järgmiselt:
1) lahustuv2) lahustumatu3) halvasti lahustuv Slide13.
Kaaluge ainete lahustuvuse tabelit.
Lahustustabeli kasutaminekirjutage lauale ainete näited.
Ba (OH) 2,KCl,BaSO4, CaSO4,NaN03, CuSO4, HN03, AgCl,FeS, Ca (OH) 2
Slaid 14. Vee dissotsiatsioonitegur.
Slaid 15. Veekatalüsaator.
Meenuta, mis on katalüsaator?
Slide 16. Ainete veetransport.
Sõnum
Sõna otseses mõttes toimub iga keha protsess vee abil. Iga rakk on veega küllastunud, iga keemiline reaktsioon toimub vee abil. See hõlmab keemilisi reaktsioone, mis toimuvad teie kehas ja toodavad energiat, aidates teil jääda aktiivseks ja omada tõhusat ainevahetust. Kuna vesi on vere koostisosa, mis varustab teie keha toitainetega, peab veres olema piisavalt vett, et iga raku toitaineid toita. Vee puudumine aeglustab ainevahetust.
Slaid 17. Vesi - reaktiiv Mäleta, mida vesi reageerib?
Vesi on üks kõige reaktiivsemaid aineid.
Õpilane: Oleme õppinud materjalist teada, et oksiidid, hüdriidid, leelismetallid ja muud ained (neid nimetatakse) suhtlevad veega.
Vastake mitmele küsimusele.
Mis moodustub aluselise oksiidi ja vee vahel?
Kirjutage sülearvuti reaktsioonivõrrandid.
Õppematerjali õppimise kontroll.
Õpetaja: Nii, sõitsime lõplikku jaama.
Slaid 19. Mis aineid vesi reageerib? Kirjutage reaktsiooni võrrandid üles (Töö paarides) Seejärel kontrollime ülesande täitmist.
Slaid 18. Määrake vee roll loetletud protsessides.
Kirjutage sülearvutisse, seejärel kontrollige.
20. slaid. Mis see on? Millist rolli mängib vesi?
Lugu 21. Christina loeb vee kohta salmi.
Me järeldame: Mis on vesi?
Slaid 22. Hoolitse vee eest.
Õpetaja : Pea meeles, et puhtad veevarud vähenevad pidevalt jame peame vett säästma.
10. Peegeldus
Õpilaste laudadel on kolm värvilist kaarti, millega hindame õppetundi.
Sinine kaart on “3”, kollane kaart on “4”, punane kaart on “5”.
Kuidas hindate oma tänases õppetükis omandatud teadmisi?
Kuidas hindate oma klassikaaslaste tööd klassis?
Kuidas hindate õppetundi tervikuna?
Õppetundide hindamine.
11. Kodutöö: punkt 17, № 3,4,5.
Olga Golikova
Ettekanne kajastab vee füüsikalisi omadusi; arvestades ainete liigitamist vees lahustuvusega; vesilahuste ja elektrolüütide määramine. Esitatakse elektrolüütilise dissotsiatsiooni teooria (TED) peamised sätted. Hapete, aluste ja soolade definitsioonid on toodud TED-i positsioonilt, näidatud on vee kui sõiduki ja keemiliste reaktsioonide osaleja roll.
Allalaadimine:
Eelvaade:
Esitluse eelvaate kasutamiseks looge endale Google'i konto (konto) ja logige sisse: https://accounts.google.com
Slaidide pealdised:
Teostab 11. klassi üliõpilane Olga Golikova Keemiaõpetus teemal: Vee roll keemilistes reaktsioonides
Vesi on Maa kõige levinum lahusti, mis määrab suurel määral maapinna keemia kui teaduse olemuse. Enamik keemiast, kui see sündis kui teadus, algas just nagu ainete vesilahuste keemia. Süstemaatiline nimetus: vesinikoksiid Traditsioonilised nimetused: vesi Keemiline valem: H20 Molaarmass: 18,01528 g / mol
Vesi on värvi, lõhna ja maitseta vedelik, t Kip = 100 ° C, t PL = 0 ° C, p = 1 g / cm3 (4 ° C juures). Vesi ei läbi elektrivoolu, soojendab halvasti, vee soojus on väga kõrge. Vesi on ainus aine, mis kõvenemisel kõveneb. Seetõttu on jää tihedus väiksem kui vedeliku tihedus. Sellepärast jääb vesi vee pinnale. Vesi
Vesi on ainulaadne kemikaal, mille rolli keemilistes reaktsioonides on raske ülehinnata Reaktsioonikeskkond Dissotsiatsioonitegur Ained reaktiivi katalüsaator
Veekeskkonnas toimub suur hulk keemilisi reaktsioone. Vees lahustuv on kõik ained tavaliselt jaotatud kolme rühma: ainete lahustuvus vees
Need on homogeensed süsteemid, mis koosnevad veemolekulidest, lahustuvatest osakestest ja nende koostoimetest, hüdratatsiooniprotsess on vee ja soluutmolekulide vahelise koostoime tulemus.
Ained, mis lagunevad lahustes ioonideks, eralduvad. Ioonidesse laguneva aine moolide arvu ja lahustunud aine koguhulka nimetatakse elektrolüütilise dissotsiatsiooni astmeks.Kõik elektrolüüdid jagunevad: - tugevaks (dissotsiatsiooni aste kaldub ühtseks) - nõrk (lahustab väga vähe lahustes) Elektrolüüdid
Svante August Arrhenius (1859-1927) Rootsi keemia ja füüsik. 1887. aastal sõnastas ta lõpuks elektrolüütilise dissotsiatsiooni teooria, 1887. aastal selgitas elektrolüütilahuste tagasitõmbumist Vant-Hoffi ja Raoult'i seadustest (näitas parandusteguri i füüsilist tähendust). Ta lõi isohüdrilisuse teooria, töötas välja soola hüdrolüüsi teooria. Tuvastati enamiku elektrolüütide dissotsiatsiooniprotsesside eksotermiline olemus ja nende protsesside kiiruse ja täielikkuse sõltuvus temperatuurist. Elektrolüütilise dissotsiatsiooni teooria
Happed on elektrolüüdid, mis lagunevad vesiniku katioonideks ja happeliste jääkide anioonideks; Alused on elektrolüütid, mis eralduvad metalli katioonidest (ammoonium- või orgaaniline alus) ja hüdroksiidi anioonidest, soolad on elektrolüütid, mis eralduvad metalli katioonidest (ammoonium- või orgaaniline alus) ja happe jääkide anioonidest.
Kõik vedelad keskkonnad on rohkem kui 90-98% vett; Veri kannab kogu kehas hapnikku, toitaineid, hormone ja muid ühendeid, eemaldades samal ajal süsinikdioksiidi ja lagunemissaadused.
Atsetüleenühendite hüdratatsioonireaktsioon (lisamisreaktsioon) hüdratsioonireaktsioonis karbonüülühendite moodustumisega. Kui atsetüleen on hüdraatunud, moodustub asendatud atsetüleenide, peamiselt ketoonide puhul atsetaldehüüd, vesi keemiliste reaktsioonide osalejana
See on puhta vesiniku ja hapniku allikas. Vesiniku ja hapniku koostoime toimib reaktsioonina, mis võimaldab kosmoselaevade orbiidile süstimist, vesi osaleb elektrolüüsi protsessides.
Tänan teid tähelepanu eest
1. Mis on veemolekuli struktuur? Millised on selle füüsilised omadused?
2. Laiendage vee integreerivat rolli loodusteadustes - keemia, bioloogia, füüsika ja geograafia vahel. Kas on võimalik seda täielikult teha ilma integratsiooniprobleemide struktureerimata ja ajakohastamiseta? 
3. Rääkige meile vee rollist ühiskonna majanduslike probleemide lahendamisel. 
4. Laiendage inimkonna globaalset probleemi - värske vee probleemi Maal ja soovitage seda lahendada. 
5. Rääkige meile vee rollist keemilistes reaktsioonides. 
6. Tõesta, et elektrolüütide dissotsiatsioon on hüdratatsiooniprotsessi tulemus. Millist rolli mängisid Vene keemikud elektrolüütilise dissotsiatsiooni teooria selle aspekti uurimisel? 
7. Milline on elektrolüütilise dissotsiatsiooni aste? Millised rühmad jagavad elektrolüüte vastavalt elektrolüütilise dissotsiatsiooni astmele? Esitage näiteid iga rühma esindajatest. 
8. Loetlege vee keemilised omadused. Milline neist omadustest on praktiliseks kasutamiseks? 
9. Mis on kristallilised hüdraadid? Milline protsess põhineb kipsi sidemete rakendamisel või alabasterist valmistatud toodete valmistamisel? 
10. Kirjutage üles reaktsioonivõrrandid, millega saab teha järgmisi muutusi: